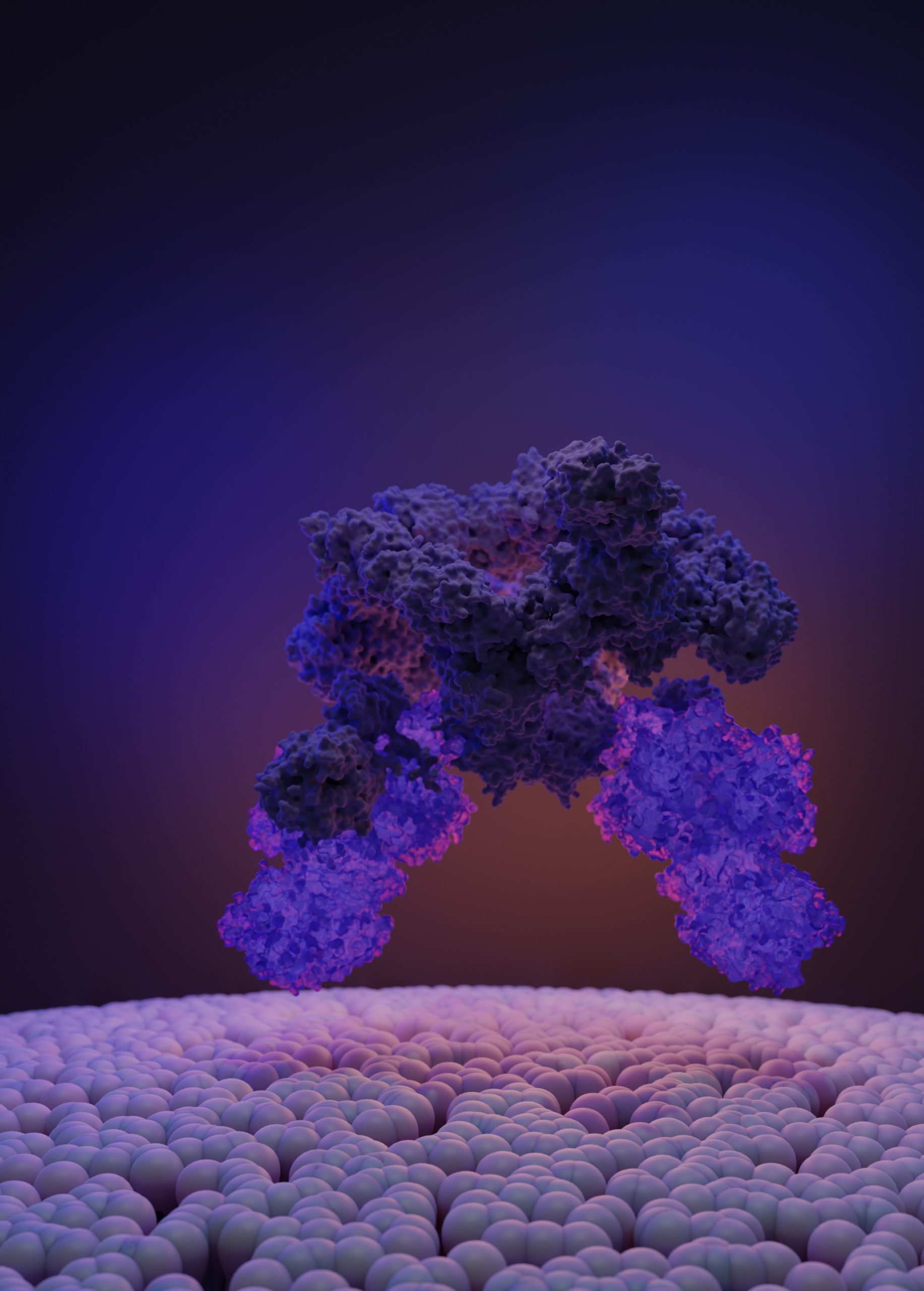
La protéine kinase TOR, au sein du complexe Target of Rapamycin 1 (TORC1), contrôle l’homéostasie (capacité à maintenir un équilibre interne stable) et la croissance cellulaire en réponse aux nutriments et aux stress. Elle est de ce fait un régulateur majeur du métabolisme cellulaire. La dérégulation de cette voie de signalisation, par un déséquilibre ou un excès de nutriments ou par des mutations génétiques, entraîne des maladies humaines chroniques telles que le syndrome métabolique, le cancer ou l’épilepsie.
Afin d’approfondir les connaissances sur la structure et la régulation de ce système complexe, les chercheurs utilisent la levure de boulanger comme modèle d’étude en raison de la conservation et la similarité de la voie de signalisation TOR avec celle de l’humain mTOR.
Grâce aux récents développements de la microscopie cryo-électronique et aux installations disponibles au Centre d’imagerie Dubochet (DCI), l’équipe du Professeur Robbie Loewith a récemment résolu la structure d’un important complexe enzymatique en amont de TORC1, connu sous le nom du complexe SEA.
De manière surprenante, la structure de ce «chaînon manquant» n’a pas révélé comment les signaux nutritifs sont communiqués à TORC1. Ceci est probablement dû au fait que des composants de la voie de signalisation de TORC1 s’associent à des membranes, qui sont exclues lors des purifications de protéines.
Pour contourner cet obstacle, les chercheurs souhaitent exploiter les dernières avancées en matière de matériel et d’expertise de pointe au DCI pour observer, dans la levure, cette structure dans son environnement natif par tomographie cryo-électronique.
Avec de telles informations, ils espèrent élucider les mystères de cette structure et éventuellement traiter les patients épileptiques possédant des mutations génétiques qui compromettent le complexe SEA.
Ce projet est rendu possible grâce au soutien de la Fondation BRYN TURNER-SAMUELS.